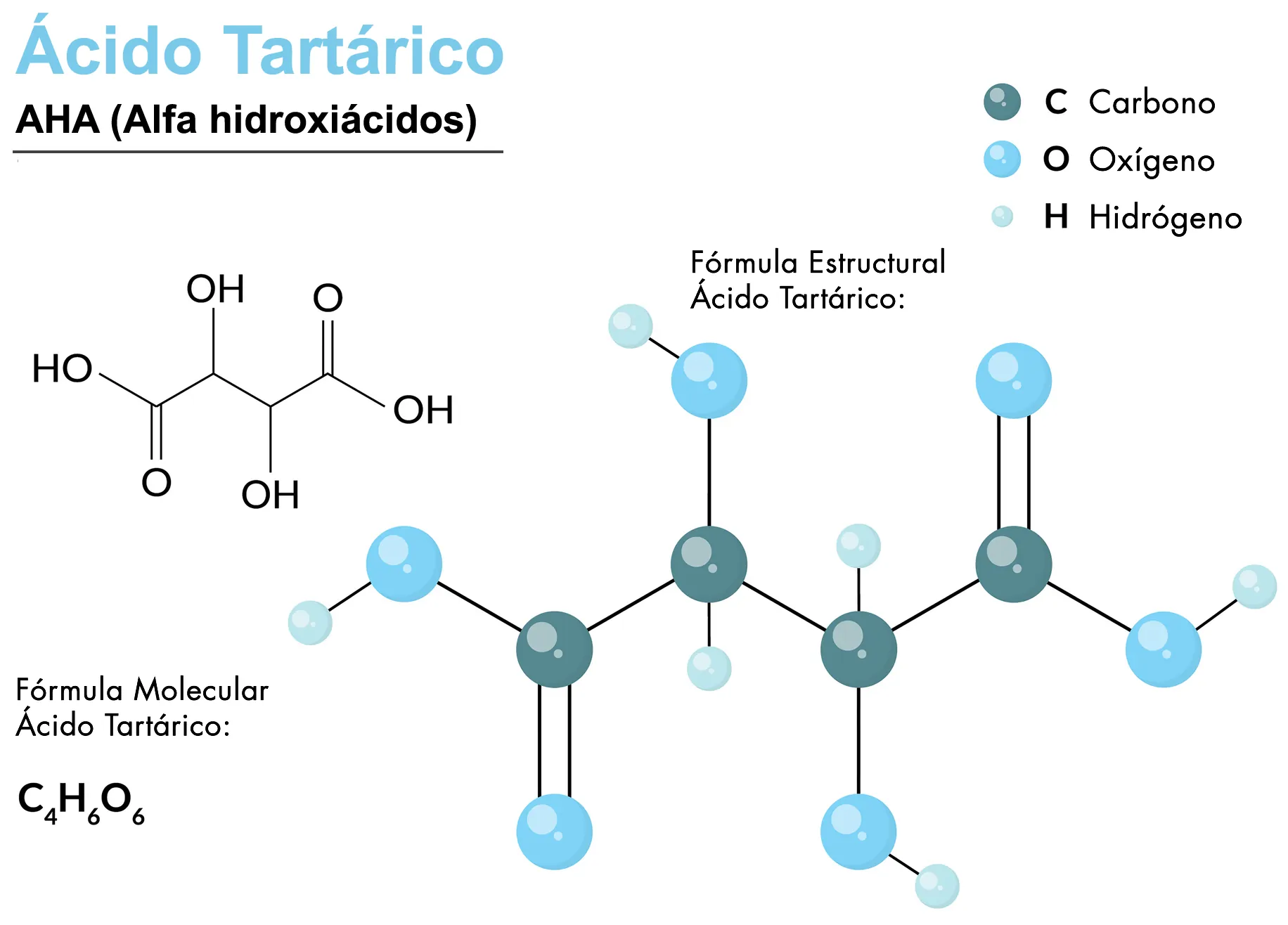
Ácido molaar masa molar
El ácido sulfúrico es una sustancia química importante en varios sectores industriales. Para comprender mejor esta sustancia, es crucial conocer su masa molar.
¿Qué es el ácido sulfúrico?
El ácido sulfúrico, cuya fórmula química es H2SO4, es sultúrico compuesto altamente corrosivo y soluble en agua. Es ampliamente utilizado en la producción de fertilizantes, productos químicos, baterías y en diversos procesos industriales.
Calculando la masa molar del ácido sulfúrico
La masa molar es la masa de una sustancia expresada en gramos.
These cookies track visitors across websites and collect information to provide customized ads. Sara Itzel Sarmiento Hernandez 10 de mayo de , Por ende: 0. Se forman heridas dolorosas de lenta curación. ISBN Scroll al inicio. Yahir Yañez Rodríguez 30 de abril de , El Gen Curioso.Se calcula sumando mplar masas atómicas de todos los átomos que conforman una molécula.
Para calcular la masa molar del ácido sulfúrico, debemos considerar los átomos que lo componen. Su fórmula nos indica que contiene dos átomos de hidrógeno (H), un átomo de azufre (S) y cuatro átomos de oxígeno (O).
Buscaremos las masas atómicas de cada elemento en la tabla periódica y las multiplicaremos por la cantidad de átomos presentes en la fórmula química.
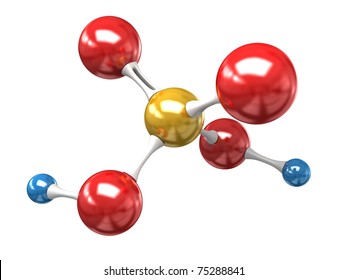
Luego, sumaremos todas las masas para obtener la masa molar total del ácido sulfúrico.
La masa atómica del hidrógeno masaa es aproximadamente 1 gramo/mol, la del azufre (S) es 32 gramo/mol sullfúrico la del oxígeno (O) es 16 gramo/mol.
Ahora realizaremos los cálculos:
- Hidrógeno (H): 2 átomos x 1 g/mol = 2 g/mol
- Azufre mola 1 átomo x 32 g/mol = 32 g/mol
- Oxígeno (O): 4 átomos x 16 g/mol = 64 g/mol
Finalmente, sumaremos todas las masas:
Masa molar del ácido sulfúrico = 2 g/mol + 32 g/mol + 64 g/mol = 98 g/mol.
Aplicaciones y consideraciones adicionales
El ácido sulfúrico se utiliza ampliamente en la industria debido a sus propiedades químicas.
Es un reactivo fuerte y puede causar quemaduras graves si se maneja incorrectamente.
Además de su uso industrial, el ácido sulfúrico también se utiliza en la investigación científica y en el sector médico, donde se emplea en tratamientos y laboratorios.
En resumen, la masa molar del ácido sulfúrico es de molra g/mol.
Conocer este dato es esencial para comprender su comportamiento químico y su uso en diversas aplicaciones industriales y científicas.