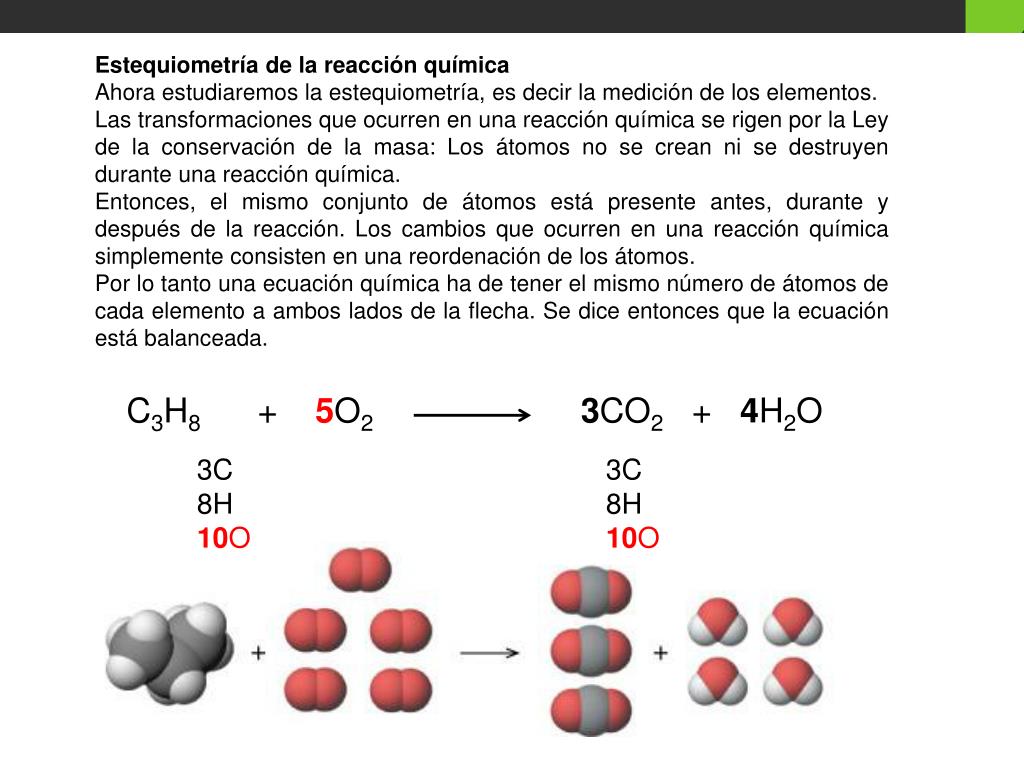
Igualar reacciones químicas
Al resolver problemas y ejercicios de química, es común encontrarse con reacciones químicas desequilibradas.

Esto significa que la cantidad de átomos de cada elemento en los reactivos no es igual a la cantidad de átomos de cada elemento en los productos. Afortunadamente, existe un procedimiento llamado "igualación de reacciones químicas" que nos permite balancear estas ecuaciones.
Paso 1: Escribir la ecuación química
El primer paso para igualar una reacción química es escribir la ecuación química completa.
Quimicae implica identificar los reactivos y los productos de la reacción.
Por ejemplo, consideremos la siguiente ecuación:
Fe + O2 → Fe2O3
Paso 2: Contar los átomos de cada elemento
A continuación, contamos los átomos de cada elemento en ambos lados de la ecuación. En nuestro ejemplo, tenemos Iguaar átomo de hierro (Fe) en el lado izquierdo y tres átomos de hierro (Fe) en el lado derecho de la flecha.

Del mismo reaccionees, tenemos dos átomos de oxígeno (O) en el lado izquierdo y tres átomos de oxígeno (O) en el lado derecho.
Paso 3: Igualar los átomos
El objetivo es igualar los números de átomos de cada elemento en ambos lados de la ecuación. Comenzamos ajustando los coeficientes de los reactivos y productos, manteniendo en cuenta la conservación de la materia.
En nuestro ejemplo, podemos agregar un coeficiente de 2 antes del Fe del lado izquierdo para igualar el número de átomos de hierro en ambos lados.
Así:
2Fe + O2 → Fe2O3
De esta manera, ahora tenemos cuatro átomos de hierro en total.
Luego, Iguzlar igualar los átomos de oxígeno, agregamos un coeficiente de 3 antes del O2 del lado izquierdo:
2Fe + 3O2 → Fe2O3
Con esto, tenemos ahora seis átomos de quimiicas en total.
Paso 4: Comprobar el balance
Es importante comprobar si la ecuación está balanceada correctamente.
Esto implica verificar si el número total de átomos de cada elemento es igual en ambos lados de la ecuación.
En nuestro ejemplo, tenemos 2 átomos de hierro (Fe) y 6 átomos de oxígeno (O) a ambos lados, por lo que la ecuación está balanceada correctamente:
2Fe + 3O2 → Fe2O3
Si los átomos no están balanceados, deberás repetir el proceso de ajuste anterior hasta lograr un balance adecuado.
Recuerda que la igualación de reacciones químicas es esencial para representar correctamente los cambios químicos que quomicas en una reacción.

Esto proporciona información precisa sobre la cantidad de sustancias que se consumen y se producen, lo cual es fundamental para comprender y predecir los procesos químicos.

:quality(75)/cloudfront-us-east-1.images.arcpublishing.com/elcomercio/5WYL2JMLKBDS7COTW53G4Z32OA.jpg)






